Effects of Water Stress on Drought Resistance Physiological Characteristics of Pinus tabulaeformis
-
摘要:
目的 探究水土保持主要造林树种油松(Pinus tabulaeformis)在水分胁迫下的抗旱生理特性, 为该地区油松人工林管理提供科学依据。 方法 以1年生油松幼苗为研究对象, 设置4个水分胁迫处理, 分别为对照组(CK)、轻度胁迫(RE25%)、中度胁迫(RE50%)和重度胁迫(RE75%), 分析不同水分胁迫处理后油松幼苗的生长特性、水力功能及渗透调节物质含量的变化及其之间的相关关系。 结果 (1) 与CK相比, 经过20个月的RE50%和RE75%处理后油松地上生物量分别显著降低19.1%和37.0%, 地下生物量分别显著增加13.7%和23.9%。(2) CK、RE25%、RE50%和RE75%处理后油松幼苗新枝的抗栓塞水势阈值分别为-1.43, -2.04, -0.91, -0.58 MPa。(3)与CK相比, 经过RE50%和RE75%处理后粗根内的可溶性糖分别显著增加123.3%和121.9%, 淀粉分别显著增加15.0%和58.0%, 非结构性碳水化合物(NSC)总量分别显著增加104.0%和83.2%。与CK相比, 经过RE75%处理后新枝内脯氨酸显著降低43.0%, K+显著降低23.7%。(4)不同水分胁迫处理下各器官内渗透调节物质对水力功能变化的贡献依次为NSC、淀粉、可溶性糖、K+、管胞汁液内的脯氨酸和管胞汁液内的可溶性糖。 结论 轻度水分胁迫提高新枝的抗栓塞能力, 而中度和重度水分胁迫下油松幼苗通过增加根内碳储存维持油松的生长代谢。油松各器官通过积累渗透调节物质提高细胞浓度, 降低渗透势以适应水分胁迫环境。研究结果加深对油松抗旱机制的认识, 为黄土高原油松人工林管理提供科学依据。 Abstract:Objective Exploring the drought resistance characteristics of Pinus tabulaeformis, a major afforestation tree species for soil and water conservation, under different water stress to provide a scientific basis for the management of P. tabulaeformis artificial forests in the region. Methods Using one-year P. tabulaeformis seedings as the research subject, four levels of water stress treatments were set up, which were control group (CK), mild stress (RE25%), moderate stress (RE50%) and severe stress (RE75%), respectively, the growth characteristics, hydraulic function and osmotic regulatory substance content of P.tabulaeformis seedlings were analyzed after different water stress treatments, and their correlation was analyzed. Results (1) Compared with the CK treatment, after twenty months of RE50% and RE75% treatment, the aboveground biomass of P. tabulaeformis significantly decreased by 19.1% and 37.0%, respectively, while the underground biomass significantly increased by 13.7% and 23.9%, respectively. (2) In the CK, RE25%, RE50% and RE75% treatments, the water potential threshold for embolism resistance of P. tabulaeformis new branches was -1.43, -2.04, -0.91 and -0.58 MPa, respectively. (3) Compared with CK, in the RE50% and RE75% treatments, the soluble sugar content in the coarse roots significantly increased by 123.3% and 121.9%, respectively, the starch content significantly increased by 15.0% and 58.0%, respectively, and the total nonstructural carbohydrate (NSC) content significantly increased by 104.0% and 83.2%, respectively. In the RE75% treatment, the proline content in the new branches significantly decreased by 43.0%, while the K+ content decreased by 23.7% compared with the CK group. (4) The contribution rates of various osmotic regulating substances in various organs to hydraulic function under different water stress were as follows: NSC, starch, soluble sugars, K+, proline and soluble sugars in tracheid sap. Conclusion Mild water stress could enhance the embolism resistance of new branches. P. tabulaeformis seedlings maintained their metabolism by increasing root carbon storage. Meanwhile, the numerous organs of P. tabulaeformis improved cell concentration, reduced osmotic potential, and preserved hydraulic function to adapt to water stress environment by coordinating the accumulation of osmotic regulating substances. This study advanced the understanding of P. tabulaeformis' drought resistance mechanism and provided a scientific basic for the management of P. tabulaeformis artificial forests on the Loess Plateau. -
黄土高原被认为是世界上土壤侵蚀最严重的地区之一[1]。自20世纪50年代以来,人们一直在实施植树造林措施以减少水土流失, 从而改善环境质量[2]。油松(Pinus tabulaeformis Carr) 是黄土高原植树造林的主要树种,具有良好的抗旱性、抗贫瘠性和抗风性,是我国干旱半干旱地区重要的水土保持造林树种[3]。但随着全球气候变化,黄土高原地区降雨量减少,蒸散量增加,导致该区域在未来可能面临更加严峻的水分胁迫[4]。有研究[5]表明,该地区油松人工林由于树种单一,水资源匮乏,导致个体生长缓慢,出现“小老头林”,甚至部分林分已出现严重衰退情况。因此,探究水分胁迫下油松抗旱性对该地区人工林的管理至关重要。
植物抗旱能力的重要方面是植物的抗栓塞能力及栓塞修复能力[6-7]。根据内聚力-张力学说,水分胁迫会引起木质部内负压增加,导致水柱断裂形成腔隙,周围组织液中的气体将通过纹孔膜进入导管,从而产生气穴阻断水分运输,导致栓塞产生[8]。SPERRY等[9]基于植物木质部导水率损失百分比(percentage loss of conductivity, PLC)和木质部水势间的关系提出栓塞脆弱性曲线(vulnerability curve)用以评估植物的栓塞抵抗能力。有研究[10]表明,随着水分胁迫程度增加,杨树木质部栓塞加剧,栓塞脆弱性减小。长期水分胁迫影响植物木质部解剖结构特征,进而影响植物的水力功能[11]。当水分胁迫超过一定阈值后,植物的栓塞修复机制对于植物水分运输系统来说至关重要[12]。一些树木通过形成新导管的方式恢复水力功能[13],而大多数树木则通过生理代谢活动调节能量和水分以恢复导管的水力功能[6, 14]。当栓塞形成后,渗透调节物质(如糖类、有机酸和K+等)从围绕导管的薄壁细胞中转运至栓塞导管,并在栓塞导管内壁上不断积累,进而提高附着在导管内壁上的水分渗透势[15]。在渗透压驱动下,水分从薄壁细胞流入栓塞导管促进栓塞导管水力恢复[16-18]。植物的抗栓塞能力和渗透调节能力是干旱条件下幼苗生存的关键,但目前关于植物在干旱条件下抗栓塞能力和渗透调节能力是否会发生变化犹未可知。因此,探究植物在属于干旱条件下水力功能和渗透调节物质含量的变化将有助于更加深入了解植物的抗旱机制。
为了探究油松的抗旱特征,本研究以1年生油松幼苗为研究对象,经过不同水分胁迫处理后,探究不同水分胁迫下油松幼苗的生长特性、水力功能及渗透调节物质的含量变化及其之间的相关关系,阐明油松的抗旱生理机制,以期为黄土高原油松林管理提供理论依据。
1. 材料与方法
1.1 研究区概况与供试材料
水分胁迫控制试验的样地布设于陕西省咸阳市杨凌区曹辛庄试验样地(34°16′25″ N,108°04′27″E),距离西北农林科技大学约3 km,海拔457 m,属半湿润森林区,年平均气温12.9 ℃,最热月(7月)平均气温25.8 ℃,最冷月(1月)平均气温-1.1 ℃;年平均降水量650 mm,生长季(4—9月)降水量占全年降水量的79%。该试验样地土壤基本信息为:有机碳8.59 g/kg,全氮0.71 g/kg,全磷0.58 g/kg。2020年栽植油松1年生幼苗,在该样地上方布设有机玻璃架,高度为2.2 m,分别遮挡0,25%,50%,75%的降雨量。于2020年11月至2022年7月进行不同梯度水分胁迫控制,分别为对照组(CK)、轻度胁迫(减雨25%,RE25%)、中度胁迫(减雨50%,RE50%)和重度胁迫(减雨75%,RE75%)。经过20个月的水分胁迫处理后,各处理组的土壤含水量分别为18.7%(CK组),16.2%(RE25%),13.7%(RE50%)和12.5%(RE75%)。每个水分胁迫处理设置3个试验样方,在每个样方四周布设深度为1 m的塑料膜,用于阻止相邻样方之间的土壤水分流动。
1.2 试验方法
1.2.1 生物量测定
经过不同水分胁迫处理后,在每个处理组随机选取10株幼苗,使用卷尺测量幼苗茎干土痕至顶芽的高度,记为株高。使用游标卡尺测量土痕处茎干的直径,记为地径。在每个干旱处理组随机选取3株幼苗,将其分为新叶、老叶、新枝、老枝、茎,按照根序将根分为一级根系、二级根系、三级根系、四级根系、五级根系和六级根系,其中六级根系为木质化的粗根。称量各组织鲜重后置于105 ℃下杀青30 min,再于65 ℃下烘干至恒重,计算其生物量。
1.2.2 水力功能测定
根据SPERRY等[9]提出的方法利用自然干燥法对每个树种建立栓塞脆弱曲线(VC)。在实验室自然状态下使枝条逐渐脱水,其间用压力室(PMS,Instrument Company,Albany,OR,USA)监测叶片水势。测定前将3~5片叶子覆盖至少1 h,以使叶片和枝条木质部水势达到平衡。3片叶片平均测量值被视为木质部的平均水势。当达到构建栓塞脆弱曲线的水势范围时,对枝条进行取样,以评估其导水率和栓塞程度。对于每个树种,在测量前将枝条浸没在水中至少30 min,随后在水下切割样本长度为(27±0.1)cm,直径为(6±0.1)mm。配置浓度为10 mmol/L的KCl溶液,并通过抽滤去除溶液中的气泡。将KCl溶液液面和实验平台之间保持50 cm高度差(产生0.005 MPa压力)。使用低压液流计(low pressure flow meter with multi-channels, LPFM)测定每个枝条样品的导水率(Ks):
$$ K_{\mathrm{s}}=F(l / \Delta P) / A_{\text {xylem }} $$ (1) 式中:F为流速(kg/s);l为枝条的长度(m);ΔP为施加在枝条上的压力差(MPa);Axylem为木质部的横截面积(m2)。
测量Ks后,将枝条连接到真空泵上,并在0.2 MPa的压力下用脱气的KCl溶液冲10~20 min直到LPFM读数稳定。冲洗后测量枝条样本的最大导水率(Kmax)。用导水率损失百分数表示测定样本的栓塞程度。自然状态下导水率损失百分数(PLC,简称为栓塞程度),计算公式为:
$$ \operatorname{PLC}(\%)=\left(K_{\max }-K_{\mathrm{s}}\right) / K_{\max } \times 100 \% $$ (2) 使用Granpad 9.0对水势与PLC进行非线性拟合(four-parameter logistic regression),公式为:
$$ \begin{gathered} Y=\min +\left(X^{\wedge} \text { Hillslope }\right) \times(\max -\min ) / \\ \left(X^{\wedge} \text { Hillslope }+ \text { EC } 50^{\wedge} \text { Hillslope }\right) \end{gathered} $$ (3) 式中:max和min分别为数据集中PLC的最大和最小值;Hillslope为拐点处回归曲线的斜率;EC50为导水率损失50%时的水势值。
1.2.3 渗透调节物质测定
(1) 非结构性碳水化合物:用球磨仪将各组织的烘干样品研磨成粉。取(0.1±0.01)g样品粉末于10 mL离心管内,加入4 mL 80%乙醇溶液,并将其置于80 ℃下水浴30 min,在水浴过程中摇动数次,然后将溶液冷却至室温。冷却后的样品在3 500 r/min转速下离心10 min,将上清液转移至25 mL容量瓶内。再重复上述步骤2次,分别加入80%乙醇溶液的量为4, 2 mL,3次共计10 mL。将上清液收集在容量瓶后定容以测定可溶性糖质量分数。取2 mL待测样品,加入5 mL蒽酮硫酸,在沸水中显色10 min,然后冷却至室温,用紫外分光光度计在620 nm下测定吸光度。
向沉淀中加入2 mL蒸馏水,在沸水中糊化15 min。冷却后,加入2 mL 9.2 mol/L HClO4,并将溶液振荡15 min,继续加入4 mL蒸馏水后,将样品在3 500 r/min下离心10 min,提取上清液于50 mL容量瓶中。将2 mL 4.6 mol/L HClO4加入到沉淀物种,振荡15 min,加入5 mL蒸馏水,离心提取上清液。用5 mL蒸馏水清洗沉淀物2次。
为了检测淀粉是否完全水解,加入碘直至不再观察到蓝色。将收集到的上清液定容以测定淀粉质量分数。计算公式为:
$$ 可溶性糖质量分数=\left(C \times V_{\mathrm{t}} \times n\right) /\left(W \times V_{\mathrm{s}} \times 1\;000\right) $$ (4) $$ 淀粉质量分数=\left(C \times V_{\mathrm{t}} \times 0.9\right) /\left(W \times V_{\mathrm{s}} \times 1\;000\right) $$ (5) $$ {\rm{NSC}}=可溶性糖质量分数+淀粉质量分数 $$ (6) C为标准曲线对应的读取吸光度的葡萄糖质量分数(μg);n为稀释比;1 000为转换系数,1 mg=1 000 μg;Vt为样品提取物总体积(mL);Vs为测定取样体积(mL);W为样品的干重(g);0.9为葡萄糖转化为淀粉的转化系数。
(2) 管胞汁液:采用高速离心法提取油松木质部管胞汁液,取去除韧皮部的油松茎段(长度为5 cm)塞满50 mL离心管后进行称重。在12 000 r/min下离心1 min以收集汁液,随后取出茎段,从底部剪去3 mm,对剩余茎段再次离心,重复此操作收集木质部汁液。收集到的管胞汁液用以测定可溶性糖和K+浓度。
(3) K+:采用H2SO4—H2O2消煮法测定K+,称取各组织植物样品0.3 g装入100 mL开氏瓶,加入5 mL浓硫酸后摇匀,用消煮炉小火加热,产生白烟后用400 ℃加热30 min,冷却后加6~7滴H2O2,再次加热消煮15 min后冷却,重复加5~6滴H2O2再消煮15 min,当消煮溶液为无色后,继续加热30 min后冷却。将消煮液全部转移到100 mL容量瓶后定容,使用原子吸收分光光度计测定。
(4) 脯氨酸:将0.1 g的植物样品置于10 mL离心管中,加入3%的磺基水杨酸溶液5 mL,沸水浴10 min,冷却后过滤,取2 mL提取液置于10 mL的离心管中,分别加入2 mL冰醋酸、2 mL酸性茚三酮,沸水浴30 min,溶液为红色。冷却至室温后加入4 mL的甲苯,3 000 r/min离心5 min后,用吸管吸取上层脯氨酸红色甲苯溶液使用分光光度计进行测定。计算公式为:
$$ 脯氨酸=\left(C \times V_{\mathrm{t}}\right) /\left(W \times V_{\mathrm{s}}\right) $$ (7) 式中:C为测定液中脯氨酸(μg);Vt为提取液体积(mL);Vs为样品的体积(mL);W为样品质量(g)。
1.2.4 数据处理
利用SPSS 23.0(IBM Corporation,Armonk,USA)软件对所有数据进行正态性检验(Shapiro-Wilk test,α=0.05)。利用单因素方差分析确定经过不同水分胁迫处理后油松生长特征、水力功能及生理特性的差异。使用Pearson相关性分析来检验生长特征、水力功能和渗透调节物质之间的关系,显著性水平均设定为p<0.05。使用主成分分析来检验各渗透调节物质对水力功能的贡献率。使用Granphpad prism 9.0绘制图表。
2. 结果与分析
2.1 水分胁迫对油松生物量的影响
由不同水分胁迫后油松的生长特征(表 1)可知,经RE25%处理后,油松株高比CK组显著增加21.5%。与CK相比,经过RE50%和RE75%处理后油松地上生物量分别显著降低19.1%和37.0%,地下生物量分别显著增加13.7%和23.9%。与CK相比,经过RE75%处理后油松根冠比显著增加20.0%。由此可见,中度和重度水分胁迫抑制油松地上组织生长,促进地下组织的生长。
表 1 不同水分胁迫处理后油松生长特征差异Table 1 Differences in growth characteristics of P. tabulaeformis after different water stress处理 株高/cm 地径/cm 地上生物量/g 地下生物量/g 细根/粗根 根冠比 CK 57.69±2.34b 13.30±0.49a 114.78±1.22a 17.51±0.88a 0.09±0.01b 0.15±0.01b RE25% 70.09±1.81a 14.14±0.89a 115.85±4.59a 18.49±0.50a 0.09±0.00b 0.16±0.00b RE50% 63.34±1.71b 14.27±0.91a 92.91±4.65b 15.11±0.49b 0.21±0.01a 0.16±0.00b RE75% 57.78±1.56b 12.54±1.11a 72.27±1.78c 13.33±0.16b 0.23±0.01a 0.18±0.01a 注:表中数据为平均值±标准差;同列不同小写字母表示不同处理间差异显著(p<0.05)。 经过不同水分胁迫处理后油松各组织生物量存在显著差异。由表 2可知,与CK相比,经过RE50%和RE75%处理后油松新叶生物量分别显著降低20.2%和42.2%,新枝生物量分别显著降低22.4%和43.8%。与CK组相比,经过RE50%和RE75%处理后二级根系生物量分别显著增加100%和90.6%,三级根系生物量分别显著增加103.9%和80.3%。与CK组相比,经过RE75%处理后,四级根系、五级根系和六级根系的生物量分别显著降低35.4%,36.1%和28.8%。由此可见,重度水分胁迫促进细根生长,抑制粗根生长。
表 2 不同水分胁迫处理后油松各组织生物量差异Table 2 Differences in biomass of various tissues of P. tabulaeformis after different water stressg 油松组织 CK RE25% RE50% RE75% 新叶 61.68±1.94a 62.85±3.07a 49.20±3.21b 35.64±1.93c 老叶 14.34±0.49ab 15.33±0.67a 11.17±1.34ab 10.28±1.99b 新枝 19.25±0.73a 17.48±0.43a 14.93±0.61b 10.82±0.95c 老枝 9.98±0.29ab 11.53±0.69a 9.32±1.14ab 7.89±0.31b 茎 9.49±0.37a 8.66±0.56a 8.29±0.89a 7.65±0.34a 一级根系 0.37±0.01b 0.35±0.04b 0.40±0.04ab 0.50±0.05a 二级根系 0.32±0.04b 0.33±0.04b 0.64±0.01a 0.61±0.02a 三级根系 0.76±0.15b 0.90±0.04b 1.55±0.04a 1.37±0.03a 四级根系 3.68±0.32a 2.47±0.25b 1.89±0.15b 2.31±0.16b 五级根系 4.76±0.03a 4.66±0.07a 2.29±0.36b 3.04±0.41b 六级根系 7.73±0.48b 9.77±0.53a 8.33±0.64ab 5.50±0.24c 注: 表中数据为平均值±标准差; 同行不同小写字母表示不同处理间差异显著(p < 0.05)。 2.2 水分胁迫对油松抗栓塞能力的影响
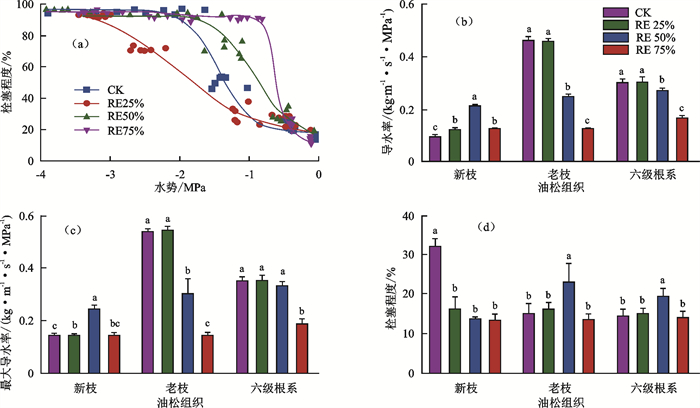
经过水分胁迫处理后,油松幼苗的抗栓塞能力发生显著变化。CK、RE25%、RE50%和RE75%处理下油松幼苗的叶片水势分别为-0.04,-0.09,-0.05,-0.10 MPa。采用自然干燥法对各处理组油松幼苗的栓塞脆弱性进行测定后发现,经RE25%处理后,油松幼苗的抗栓塞能力显著增加,但经过RE50%和RE75%处理后油松幼苗的抗栓塞能力显著降低。CK、RE25%、RE50%和RE75%处理后油松幼苗新枝的导水率损失50%(P50)的水势阈值分别为-1.43,-2.04,-0.91,-0.58 MPa(图 1a)。
经过不同水分胁迫处理后,油松幼苗各器官水力功能发生显著变化。与CK相比,经过RE25%、RE50%和RE75%处理后油松新枝导水率分别显著增加28.6%,120.9%和29.1%,经过RE50%和RE75%处理后油松老枝导水率分别显著降低45.1%和72.7%,六级根系导水率显著降低9.2%和44.9%。与CK相比,经过RE75%处理后老枝和六级根系的最大导水率分别显著降73.1%和45.1%。与CK相比,经RE25%、RE50%和RE75%处理后油松新枝栓塞程度分别显著降低48.0%,56.0%和57.3%(图 1b~图 1d)。
综上所述,经不同水分胁迫处理后,油松新枝水分运输效率显著提高,而老枝和六级根系的水分运输效率降低。
2.3 水分胁迫对油松渗透调节物质的影响
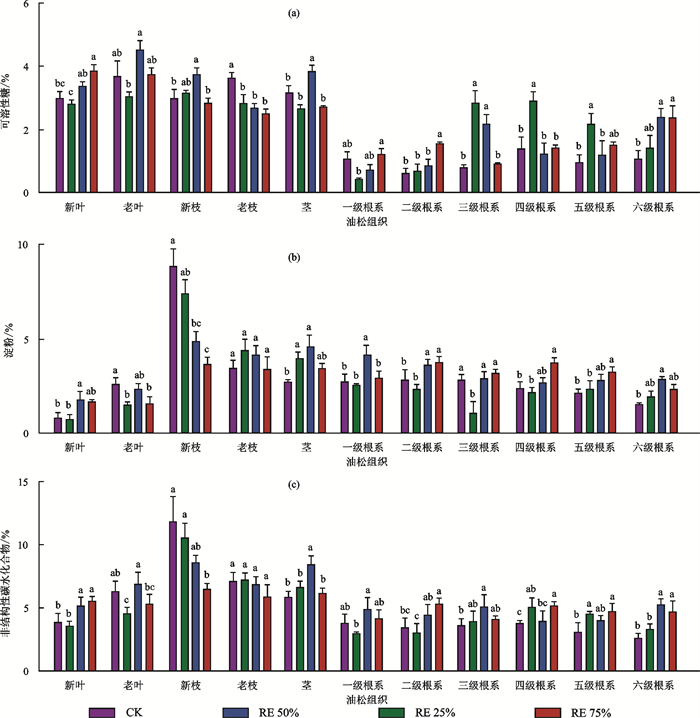
不同水分胁迫处理后油松各组织内可溶性糖发生显著变化。与CK相比,经RE50%和RE75%处理后新叶内的可溶性糖分别显著增加13.1%和29.6%,老枝内的可溶性糖分别显著降低26.3%和31.1%,六级根系内的可溶性糖分别显著增加123.3% 和121.9%(图 2a)。
不同水分胁迫处理后油松各组织内淀粉发生显著变化。与CK相比,经过RE50%和RE75%处理后新叶内淀粉分别显著增加112.9%和98.8%,新枝内的淀粉分别显著降低45.3%和58.5%,六级根系内的淀粉分别显著增加15.0%和58.0%。由此可见,在干旱条件下,油松倾向于增加粗根内的淀粉储备(图 2b)。
不同水分胁迫处理后油松各组织内NSC总量发生显著变化。与CK相比,经过RE50%和RE75%处理后新叶内NSC总量分别显著增加35.3%和44.9%,新枝内NSC总量分别显著降低27.2%和44.9%,六级根系内的NSC总量分别显著增加104.0%和83.2%(图 2c)。可见,在干旱条件下,油松碳分配格局发生改变,主要表现为地上新生组织内的NSC储备降低,而粗根内的NSC储备提高。
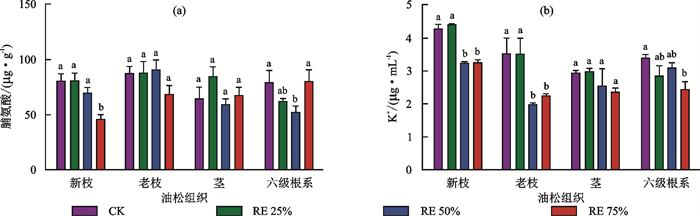
不同水分胁迫处理后油松各组织内脯氨酸发生显著变化。由图 3可知,与CK相比,经过RE75%处理后新枝内的脯氨酸显著降低43.0%,经RE50%处理后六级根系内的脯氨酸显著降低33.9%(图 3a)。不同水分胁迫处理后油松各组织内K+发生显著变化。与CK相比,经RE50%和RE75%处理后新枝内的K+分别显著降低24.4%和23.7%,老枝内的K+分别显著降低43.7%和35.8%。与CK相比,经过RE75%处理后六级根系内的K+显著降低28.0%(图 3a)。不同水分胁迫处理后油松木质部管胞汁液内的可溶性糖发生显著变化。从图 4可以看出,与CK相比,经过RE75%处理后管胞汁液内的可溶性糖显著增加126.5%。综上所述,经水分胁迫处理后,组织内的脯氨酸和K+降低,而管胞汁液内的可溶性糖提高。
2.4 油松水力功能与渗透调节物质的关系
不同水分胁迫处理后水力功能与渗透调节物质之间的关系见表 3。叶片水势与管胞汁液内的可溶性糖和管胞汁液内的脯氨酸之间呈显著负相关(p<0.001)。木质部导水率与淀粉、NSC总量、K+、管胞汁液内的可溶性糖和脯氨酸之间显著负相关(p<0.05)。木质部最大导水率与NSC总量、K+、管胞汁液内的可溶性糖和脯氨酸之间呈显著负相关(p<0.05)。木质部栓塞程度与淀粉、NSC总量和K+之间呈显著正相关(p<0.05)。
表 3 不同水分胁迫处理下水力功能与渗透调节物质相关性分析Table 3 Correlation analysis between hydraulic function and osmoregulatory substances under different water stress渗透调节物质 生物量 水势 导水率 最大导水率 栓塞 可溶性糖 0.496** 0.051 -0.206 -0.210 0.025 淀粉 0.878** 0.117 -0.373* -0.342 0.517** 非结构性碳水化合物 0.870** 0.111 -0.368* -0.344* 0.429** 脯氨酸 0.120 0.143 0.286 0.297 0.156 K+ 0.425** -0.196 -0.815** -0.783** 0.365* 可溶性糖-汁液 -0.408* -0.574** -0.472** -0.499** -0.259 脯氨酸-汁液 -0.408* -0.574** -0.472** -0.499** -0.259 K+-汁液 -0.246 0.083 -0.252 -0.262 -0.151 从表 4可以看出,不同水分胁迫处理下各渗透调节物质对水力功能的解释率为78.71%。其中组织内NSC总量的贡献率为38.4%,淀粉的贡献率为27.5%,可溶性糖的贡献率为12.8%,K+的贡献率为9.1%,管胞汁液内脯氨酸的贡献率为8.7%,管胞汁液内可溶性糖的贡献率为3.5%。
表 4 不同水分胁迫处理下影响水力功能的渗透调节物质贡献率Table 4 Contribution rate of osmoregulatory substances affecting hydraulic function under different water stress渗透调节物质 初始特征值 提取平方和载入 合计 方差贡献率/% 累积贡献率/% 合计 方差贡献率/% 累积贡献率/% 非结构性碳水化合物 3.074 38.430 38.430 3.074 38.430 38.430 淀粉 2.201 27.512 65.943 2.201 27.512 65.943 可溶性糖 1.022 12.770 78.713 1.022 12.770 78.713 K+ 0.731 9.140 87.852 脯氨酸-汁液 0.694 8.676 96.528 可溶性糖-汁液 0.278 3.472 100.00 K+-汁液 4.05E-17 5.06E-16 100.00 脯氨酸 -2.63E-16 -3.28E-15 100.00 3. 讨论
水分胁迫对油松幼苗的生长具有显著影响,中度和重度的水分胁迫处理增加油松幼苗粗根内可溶性糖、淀粉和NSC总量,从而导致油松地下生物量显著增加,而地上生物量显著降低(图 2、表 1、表 3)。胡衍平等[19]的研究结果表明,在水分胁迫环境中植物的生物量表现为地下生物量显著大于地上生物量。造成这种变化的原因可能是在水分胁迫条件下,植物通过改变叶、枝、根生物量进而改变植物的碳分配格局来减少水分胁迫造成的伤害[20]。GALIANO等[21]关于水分胁迫下植物NSC总量变化的研究表明,在严重干旱2个月后植物组织内的NSC总量逐渐增加,且可溶性糖是NSC增加的主要成分,该结果与本研究的结果一致。造成这种变化的原因为在干旱期间,随着水分供应的减少,植物呼吸作用受到抑制,但是叶片的光合作用仍能维持,从而导致组织内NSC被积累[22-23]。GALIANO等[21]研究表明,造成这种变化的原因是在水分胁迫的环境下,植物通过积累可溶性糖维持渗透调节作用,从而促进栓塞的修复;KANNENBERG等[24]的研究表明,非等水植物在干旱期间不会减少NSC总量,而是将其储存起来并在干旱后用以栓塞修复。因此,本研究认为在长期中度和重度的水分胁迫下,油松幼苗通过调节自身可溶性糖、淀粉及NSC总量来维持逆境下植物各组织的生理代谢需求,促进根的生长速率,适应干旱环境。
水分胁迫对油松新枝抗栓塞能力具有显著影响,主要表现为轻度水分胁迫提高新枝的抗栓塞性,中度和重度水分胁迫降低新枝的抗栓塞性(图 1)。刘丽等[10]研究表明,轻度水分胁迫下杨树的栓塞脆弱性减小,对栓塞的抵抗能力增强,与本研究的结果一致。根据PANDEY[25]的研究结果,在干旱条件下,植物通过一系列适应性机制来应对环境胁迫,其中包括改变木质部的结构特征以增强抗栓塞能力。结合本研究结果认为,在轻度水分胁迫下,油松幼苗可能发生结构水平的可塑性变化,包括管胞直径、管胞壁厚度及管胞密度等[26]。这些结构的变化均有助于提高枝条的抗栓塞性,从而减少水分蒸发和栓塞的风险,有利于植物在干旱环境下的存活和生长[27]。本研究结果也表明,中度和重度水分胁迫下,枝条的抗栓塞性显著降低。邵畅畅等[28]研究发现,在严重干旱条件下,植物木质部的管胞面积增加,但管胞壁变薄,细胞出现破裂现象,导致木质部栓塞风险增加,自然栓塞程度增加,与本研究中严重水分胁迫下油松抗栓塞能力降低的结果相似。造成这种现象的原因可能是该水分条件下,植物面临较大的水分压力,导致木质部结构的调整可能对抗栓塞能力产生不利影响。WHEELER等[29]的研究也表明,严重水分胁迫下植物形成的管胞长度越长,纹孔膜上大空隙所占的比例越大,木质部越容易发生栓塞。因此,本研究认为,油松幼苗在不同的干旱条件下表现出不同的木质部适应性,在一定的水分胁迫程度内,植物木质部抗栓塞能力增加,但严重的水分胁迫对植物木质部抗栓塞能力产生不利影响。
水分胁迫下油松通过调节各器官渗透调节物质维持木质部的水力功能(表 3、表 4)。王云霞等[30]研究表明,连翘通过调节器官间的碳分配模式及NSC含量来应对长期严重的水分胁迫,与本研究结果一致。CHEN等[6]的研究表明,水分胁迫对植物的生长和生理功能产生广泛影响,在干旱条件下,植物积累的可溶性糖和淀粉不仅可以作为碳源和能量储备以维持正常的生长和代谢活动,还影响木质部的水力功能;也有研究[31]表明,可溶性糖、淀粉和高水平的NSC总量在植物维持细胞膨压和渗透调节方面发挥着重要的作用。脯氨酸是植物体内一种重要的氨基酸,有研究[32]表明,该物质在植物的应激反应和抗氧化防御中发挥着重要的作用。在水分胁迫下,植物积累的脯氨酸有利于植物维持细胞结构稳定和促进渗透调节作用[33-34]。FANG等[35]的研究结果表明,在干旱条件下,K+影响植物的渗透调节以减轻水分胁迫造成的损伤。结合本研究结果,在重度水分胁迫下根内可溶性糖和NSC总量显著增加,而新枝内的各渗透调节物质呈降低的趋势。因此,本研究认为, 在重度水分胁迫下油松更倾向于维持根的水力安全,通过在根内积累可溶性糖及NSC总量来提高根内细胞液浓度,降低其渗透势,提高根内细胞的吸水和保水能力[36];与此同时,新枝的渗透调节能力可能显著降低。通过主成分分析,本研究结果也强调在不同水分胁迫处理下NSC总量、淀粉及可溶性糖是影响木质部水力功能的主要渗透调节物质[30]。综上所述,在水分胁迫下,油松各器官的可溶性糖、淀粉、NSC总量、K+及管胞汁液中的脯氨酸等渗透调节物种共同影响着木质部的水力功能,且重度水分胁迫下粗根的渗透调节作用对植物在干旱环境中维持正常的生长代谢和水力功能至关重要。
4. 结论
(1) 在中度和重度水分胁迫下,油松通过增加粗根内可溶性糖、淀粉及NSC总量促进地下根系的生长,但是新枝中的淀粉及NSC储备降低导致地上部分的生长受限。由此可见,油松能够通过调节地上和地下组织的碳分配格局来减少水分胁迫造成的伤害。
(2) 轻度的水分胁迫有助于植物提高新枝的栓塞抵抗能力,但中度和重度的水分胁迫降低油松新枝的抗栓塞能力。因此在植树造林的过程中,可以对油松幼苗进行轻度的水分胁迫处理以提高幼苗的栓塞抵抗能力,从而增加幼苗在干旱环境中的存活率。
(3) 在重度水分胁迫下油松更倾向于维持根的水力安全,植物通过提高根木质部内可溶性糖和NSC总量来提高根的渗透调节能力,提高根内细胞的吸收和保水能力,但新枝的渗透调节能力可能显著降低。由此可见,重度水分胁迫下根的渗透调节作用对植物逆境中维持水力功能和生长代谢至关重要。
-
表 1 不同水分胁迫处理后油松生长特征差异
Table 1 Differences in growth characteristics of P. tabulaeformis after different water stress
处理 株高/cm 地径/cm 地上生物量/g 地下生物量/g 细根/粗根 根冠比 CK 57.69±2.34b 13.30±0.49a 114.78±1.22a 17.51±0.88a 0.09±0.01b 0.15±0.01b RE25% 70.09±1.81a 14.14±0.89a 115.85±4.59a 18.49±0.50a 0.09±0.00b 0.16±0.00b RE50% 63.34±1.71b 14.27±0.91a 92.91±4.65b 15.11±0.49b 0.21±0.01a 0.16±0.00b RE75% 57.78±1.56b 12.54±1.11a 72.27±1.78c 13.33±0.16b 0.23±0.01a 0.18±0.01a 注:表中数据为平均值±标准差;同列不同小写字母表示不同处理间差异显著(p<0.05)。 表 2 不同水分胁迫处理后油松各组织生物量差异
Table 2 Differences in biomass of various tissues of P. tabulaeformis after different water stress
g 油松组织 CK RE25% RE50% RE75% 新叶 61.68±1.94a 62.85±3.07a 49.20±3.21b 35.64±1.93c 老叶 14.34±0.49ab 15.33±0.67a 11.17±1.34ab 10.28±1.99b 新枝 19.25±0.73a 17.48±0.43a 14.93±0.61b 10.82±0.95c 老枝 9.98±0.29ab 11.53±0.69a 9.32±1.14ab 7.89±0.31b 茎 9.49±0.37a 8.66±0.56a 8.29±0.89a 7.65±0.34a 一级根系 0.37±0.01b 0.35±0.04b 0.40±0.04ab 0.50±0.05a 二级根系 0.32±0.04b 0.33±0.04b 0.64±0.01a 0.61±0.02a 三级根系 0.76±0.15b 0.90±0.04b 1.55±0.04a 1.37±0.03a 四级根系 3.68±0.32a 2.47±0.25b 1.89±0.15b 2.31±0.16b 五级根系 4.76±0.03a 4.66±0.07a 2.29±0.36b 3.04±0.41b 六级根系 7.73±0.48b 9.77±0.53a 8.33±0.64ab 5.50±0.24c 注: 表中数据为平均值±标准差; 同行不同小写字母表示不同处理间差异显著(p < 0.05)。 表 3 不同水分胁迫处理下水力功能与渗透调节物质相关性分析
Table 3 Correlation analysis between hydraulic function and osmoregulatory substances under different water stress
渗透调节物质 生物量 水势 导水率 最大导水率 栓塞 可溶性糖 0.496** 0.051 -0.206 -0.210 0.025 淀粉 0.878** 0.117 -0.373* -0.342 0.517** 非结构性碳水化合物 0.870** 0.111 -0.368* -0.344* 0.429** 脯氨酸 0.120 0.143 0.286 0.297 0.156 K+ 0.425** -0.196 -0.815** -0.783** 0.365* 可溶性糖-汁液 -0.408* -0.574** -0.472** -0.499** -0.259 脯氨酸-汁液 -0.408* -0.574** -0.472** -0.499** -0.259 K+-汁液 -0.246 0.083 -0.252 -0.262 -0.151 表 4 不同水分胁迫处理下影响水力功能的渗透调节物质贡献率
Table 4 Contribution rate of osmoregulatory substances affecting hydraulic function under different water stress
渗透调节物质 初始特征值 提取平方和载入 合计 方差贡献率/% 累积贡献率/% 合计 方差贡献率/% 累积贡献率/% 非结构性碳水化合物 3.074 38.430 38.430 3.074 38.430 38.430 淀粉 2.201 27.512 65.943 2.201 27.512 65.943 可溶性糖 1.022 12.770 78.713 1.022 12.770 78.713 K+ 0.731 9.140 87.852 脯氨酸-汁液 0.694 8.676 96.528 可溶性糖-汁液 0.278 3.472 100.00 K+-汁液 4.05E-17 5.06E-16 100.00 脯氨酸 -2.63E-16 -3.28E-15 100.00 -
[1] 赵阳, 张永娥, 王昭艳, 等. 水土保持生态建设下的黄土高原典型流域水沙响应[J]. 中国水土保持科学(中英文), 2024, 22(1): 21-26. ZHAO Y, ZHANG Y E, WANG Z Y, et al. Response of water and sediment to ecological construction of soil and water conservation in the typical watersheds of the Loess Plateau[J]. Science of Soil and Water Conservation, 2024, 22(1): 21-26. [2] JIA X X, SHAO M A, ZHU Y J, et al. Soil moisture decline due to afforestation across the Loess Plateau, China[J]. Journal of Hydrology, 2017, 546: 113-122. doi: 10.1016/j.jhydrol.2017.01.011 [3] 邹书珍, 尹才佳, 杨茜, 等. 子午岭次生油松林立木竞争格局研究[J]. 植物研究, 2023, 43(1): 140-149. ZOU S Z, YIN C J, YANG Q, et al. Competition pattern of standing trees in secondary Pinus forest in the Ziwuling Mountains, China[J]. Bulletin of Botanical Research, 2023, 43(1): 140-149. [4] 宋进喜, 高隽清, 李晓鑫, 等. 近20年来黄土高原蒸散发变化规律及其驱动因素[J]. 西北大学学报(自然科学版), 2023, 53(6): 974-990. SONG J X, GAO J Q, LI X X, et al. Changes of evapotranspiration and its driving factors in the Loess Plateau in recent 20 years[J]. Journal of Northwest University (Natural Science Edition), 2023, 53(6): 974-990. [5] 何如梦, 王百田, 于显威, 等. 晋西黄土区油松林的生长释放与生长抑制[J]. 应用与环境生物学报, 2018, 24(6): 1204-1210. HE R M, WANG B T, YU X W, et al. Growth release and growth inhibition of Pinus tabulaeformis forest in the Loess Plateau of western Shanxi Province, China[J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(6): 1204-1210. [6] CHEN Z C, ZHU S D, ZHANG Y T, et al. Tradeoff between storage capacity and embolism resistance in the xylem of temperate broadleaf tree species[J]. Tree Physiology, 2020, 40(8): 1029-1042. doi: 10.1093/treephys/tpaa046 [7] YU Y C, LIU J X, SUN Z Y. Transcriptome profiling in Salix matsudana during refilling xylem vessels after embolism[J]. Biologia Plantarum, 2019, 63: 425-431. [8] ZIMMERMANN M H. Xylem structure and the ascent of sap [M]. Berlin: Springer, 1983. [9] SPERRY J, DONNELLY J R, TYREE M. A method for measuring hydraulic conductivity and embolism in xylem [J]. Plant Cell and Environment, 1988, 11: 35-40. doi: 10.1111/j.1365-3040.1988.tb01774.x [10] 刘丽, 张立, 蔡靖, 等. 干旱胁迫及复水后84K杨栓塞修复及其他水力学特性的研究[J]. 北京林业大学学报, 2021, 43(7): 22-30. LIU L, ZHANG L, CAI J, et al. Hydraulic characteristics and embolism repair of Populus alba×P. glandulosa after drought stress and rehydration[J]. Journal of Beijing Forestry University, 2021, 43(7): 22-30. [11] LIU Q, LIU Y, GAO L Q, et al. Vessel, intervessel pits and vessel-to-fiber pits have significant impact on hydraulic function under different drought conditions and re-irrigation[J]. Environmental and Experimental Botany, 2023, 214: e105476. doi: 10.1016/j.envexpbot.2023.105476 [12] LIU J X, GU L, YU Y C, et al. Corticular photosynthesis drives bark water uptake to refill embolized vessels in dehydrated branches of Salix matsudana[J]. Plant, Cell and Environment, 2019, 42(9): 2584-2596. doi: 10.1111/pce.13578 [13] TOMASELLA M, PETRUSSA E, PETRUZZELLIS F, et al. The possible role of non-structural carbohydrates in the regulation of tree hydraulics[J]. International Journal of Molecular Sciences, 2020, 21(1): e144. [14] TRIFILÒ P, KIORAPOSTOLOU N, PETRUZZELLIS F, et al. Hydraulic recovery from xylem embolism in excised branches of twelve woody species: Relationships with parenchyma cells and non-structural carbohydrates[J]. Plant Physiology and Biochemistry, 2019, 139: 513-520. doi: 10.1016/j.plaphy.2019.04.013 [15] SECCHI F, PAGLIARANI C, ZWIENIECKI M A. The functional role of xylem parenchyma cells and aquaporins during recovery from severe water stress[J]. Plant, Cell and Environment, 2017, 40(6): 858-871. doi: 10.1111/pce.12831 [16] AL-YASI H, ATTIA H, ALAMER K, et al. Impact of drought on growth, photosynthesis, osmotic adjustment, and cell wall elasticity in Damask rose[J]. Plant Physiology and Biochemistry, 2020, 150: 133-139. doi: 10.1016/j.plaphy.2020.02.038 [17] HOU P C, WANG F F, LUO B, et al. Antioxidant enzymatic activity and osmotic adjustment as components of the drought tolerance mechanism in Carex duriuscula[J]. Plants, 2021, 10(3): e436. doi: 10.3390/plants10030436 [18] AKTER N, BRISHTY T A, KARIM M A, et al. Leaf water status and biochemical adjustments as a mechanism of drought tolerance in two contrasting wheat (Triticum aestivum L. ) varieties[J]. Acta Physiologiae Plantarum, 2023, 45(3): e50. doi: 10.1007/s11738-023-03530-x [19] 胡衍平, 刘卫东, 庞文胜, 等. 水分胁迫对山乌桕幼苗生长及生理生化的影响[J]. 中南林业科技大学学报, 2023, 43(8): 62-72. HU Y P, LIU W D, PANG W S, et al. Effects of water stress on the growth, physiological and biochemical characteristics of Sapium discolor seedlings[J]. Journal of Central South University of Forestry and Technology, 2023, 43(8): 62-72. [20] 韦兴兰, 李树萍, 王元友, 等. 土壤含水量对树番茄苗木生长及非结构性碳水化合物的影响[J]. 经济林研究, 2024, 42(1): 178-188. WEI X L, LI S P, WANG Y Y, et al. Effect of different soil moisture content on growth and non-structural carbohydrates of Cypomandra betacea seedlings[J]. Non-wood Forest Research, 2024, 42(1): 178-188. [21] GALIANO L, TIMOFEEVA G, SAURER M, et al. The fate of recently fixed carbon after drought release: Towards unravelling C storage regulation in Tilia platyphyllos and Pinus sylvestris[J]. Plant, Cell and Environment, 2017, 40(9): 1711-1724. doi: 10.1111/pce.12972 [22] MITCHELL P J, O'GRADY A P, TISSUE D T, et al. Drought response strategies define the relative contributions of hydraulic dysfunction and carbohydrate depletion during tree mortality[J]. New Phytologist, 2013, 197(3): 862-872. doi: 10.1111/nph.12064 [23] TOMASELLA M, HÄBERLE K H, NARDINI A, et al. Post-drought hydraulic recovery is accompanied by non-structural carbohydrate depletion in the stem wood of Norway spruce saplings[J]. Scientific Reports, 2017, 7: e14308. doi: 10.1038/s41598-017-14645-w [24] KANNENBERG S A, PHILLIPS R P. Non-structural carbohydrate pools not linked to hydraulic strategies or carbon supply in tree saplings during severe drought and subsequent recovery[J]. Tree Physiology, 2020, 40(2): 259-271. doi: 10.1093/treephys/tpz132 [25] PANDEY S. Climatic influence on tree wood anatomy: A review[J]. Journal of Wood Science, 2021, 67(1): e24. doi: 10.1186/s10086-021-01956-w [26] 宋文琦. 中国北方油松木质部解剖特征对水温变化的响应[D]. 哈尔滨: 东北林业大学, 2023. SONG W Q. Responses of Pinus tabuliformis xylem anatomical characteristics to changes in moisture and temperature in Northern China[D]. Harbin: Northeast Forestry University, 2023. [27] 刘青, 王云霞, 曾岩, 等. 不同林龄刺槐解剖结构及生理特性[J]. 应用生态学报, 2023, 34(12): 3256-3262. LIU Q, WANG Y X, ZENG Y, et al. Anatomical structure and physiological characteristics of Robinia pseudoacacia of different stand ages[J]. Chinese Journal of Applied Ecology, 2023, 34(12): 3256-3262. [28] 邵畅畅, 罗仙英, 丁贵杰, 等. 干旱对马尾松茎叶水力特征及解剖特性的影响[J]. 植物生理学报, 2022, 58(5): 937-945. SHAO C C, LUO X Y, DING G J, et al. Effects of drought on hydraulic and anatomical characteristics of stem and leaf in Pinus massoniana[J]. Plant Physiology Journal, 2022, 58(5): 937-945. [29] WHEELER J K, SPERRY J S, HACKE U G, et al. Inter-vessel pitting and cavitation in woody Rosaceae and other vesselled plants: A basis for a safety versus efficiency trade-off in xylem transport[J]. Plant, Cell and Environment, 2005, 28(6): 800-812. doi: 10.1111/j.1365-3040.2005.01330.x [30] 王云霞, 刘莹, 付雨辰, 等. 干旱胁迫对连翘幼苗非结构性碳分配和水力特性的影响[J]. 生态学报, 2024, 44(11): 1-10. WANG Y X, LIU Y, FU Y C, et al. Effects of drought on non-structural carbon allocation and hydraulic characteristics of Forsythia suspense seedings[J]. Acta Ecologica Sinica, 2024, 44(11): 1-10. [31] TRIFILÒ P, CASOLO V, RAIMONDO F, et al. Effects of prolonged drought on stem non-structural carbohydrates content and post-drought hydraulic recovery in Laurus nobilis L. The possible link between carbon starvation and hydraulic failure[J]. Plant Physiology and Biochemistry, 2017, 120: 232-241. doi: 10.1016/j.plaphy.2017.10.003 [32] HUANG L J, DING L L, WANG W J, et al. Effects of simulated drought stress on the growth and physiological and biochemical parameters of Paspalum wettsteinii[J]. Acta Physiologiae Plantarum, 2023, 45(6): e82. doi: 10.1007/s11738-023-03556-1 [33] 李小玲, 华智锐. 温度与水分胁迫下黄芩的渗透调节能力与交叉关系研究[J]. 江苏农业科学, 2023, 51(21): 162-168. LI X L, HUA Z R. Study on osmotic regulation ability and cross relationship of Scutellaria baicalensis under temperature and water stress[J]. Jiangsu Agricultural Sciences, 2023, 51(21): 162-168. [34] 梁青兰, 韩友吉, 乔艳辉, 等. 干旱胁迫对黑杨派无性系生长及生理特性的影响[J]. 北京林业大学学报, 2023, 45(10): 81-89. doi: 10.12171/j.1000-1522.20220266 LIANG Q L, HAN Y J, QIAO Y H, et al. Effects of drought stress on the growth and physiological characteristics of Sect. Aigeiros clones[J]. Journal of Beijing Forestry University, 2023, 45(10): 81-89. doi: 10.12171/j.1000-1522.20220266 [35] FANG S, YANG H Y, WEI G W, et al. Potassium application enhances drought tolerance in sesame by mitigating oxidative damage and regulating osmotic adjustment[J]. Frontiers in Plant Science, 2022, 13: e1096606. doi: 10.3389/fpls.2022.1096606 [36] 张金菊, 田青, 郭有燕, 等. 黑果枸杞根系对干旱胁迫响应的生理机制[J]. 甘肃农业大学学报, 2023, 58(4): 183-191. ZHANG J J, TIAN Q, GUO Y Y, et al. Physiological mechanism of root response to drought stress in Lycium ruthenicum[J]. Journal of Gansu Agricultural University, 2023, 58(4): 183-191.

 下载:
下载: